Trung Tâm Luyện Thi Đại Học
Bài 7. Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Mở đầu – Trang 40
Trong một chu kì của bảng tuần hoàn, tính chất của các oxide và hydroxide biến đổi theo xu hướng nào?
Hướng dẫn giải:
Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
I. Thành phần của các oxide và hydroxide – Trang 40
Nguyên tố gallium thuộc nhóm IIIA và nguyên tố selenium thuộc nhóm VIA của bảng tuần hoàn. Viết công thức hóa học của oxide, hydroxide (ứng với hóa trị cao nhất) của hai nguyên tố trên.
Hướng dẫn giải:
Nguyên tố gallium có công thức oxide và hydroxide lần lượt là Ga2O3 và Ga(OH)3.
Nguyên tố selenium có công thức oxide và hydroxide lần lượt là SeO3 và H2SeO4.
II. Tính chất của oxide và hydroxide – Trang 41
Trong một thí nghiệm, cho lần lượt các oxide Na2O, MgO, P2O5vào nước, nhúng giấy quỳ tím vào dung dịch sau phản ứng, hiện tượng phản ứng được trình bày trong bảng sau:
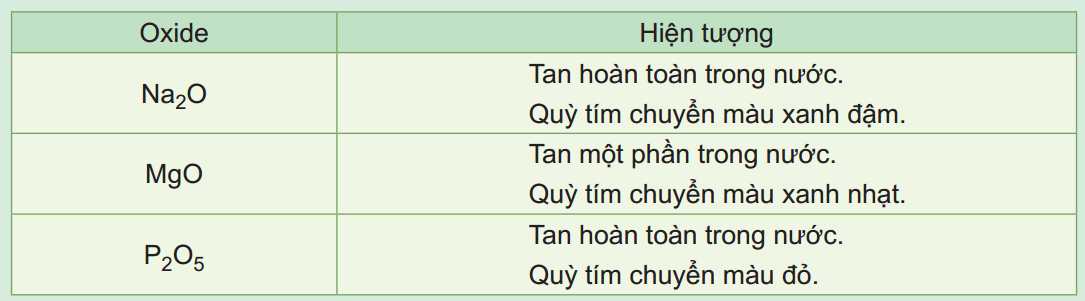
Trả lời câu hỏi:
1. Viết phương trình hóa học của các phản ứng xảy ra trong các thí nghiệm trên.
2. So sánh tính acid – base của các oxide và hydroxide tương ứng.
Hướng dẫn giải:
1. Các phản ứng hóa học minh họa:
Na2O + H2O ⟶ 2NaOH
MgO + H2O ⟶ Mg(OH)2
P2O5 + 3H2O ⟶ 2H3PO4
2.
Na2O; MgO là basic oxide; P2O5 là acidic oxide.
NaOH là base mạnh, Mg(OH)2 là base yếu, H3PO4 là acid trung bình.
Chiều giảm dần tính base và tăng dần tính acid của các oxide và hydroxide tương ứng:
Oxide: Na2O; MgO; P2O5
Hydroxide: NaOH; Mg(OH)2; H3PO4.
Phản ứng của muối với dung dịch acid
Chuẩn bị: dung dịch Na2CO3; dung dịch HNO3 loãng; ống nghiệm.
Tiến hành:
Thêm từng giọt dung dịch Na2CO3 vào ống nghiệm chứa dung dịch HNO3.
Quan sát hiện tượng và trả lời câu hỏi:
a) Viết phương trình hóa học của phản ứng.
b) Hãy so sánh độ mạnh, yếu giữa acid HNO3và H2CO3.
Hướng dẫn giải:
a) Phương trình hóa học của phản ứng: \( N{{a}_{2}}C{{O}_{3}}+2HN{{O}_{3}}\xrightarrow{{}}2NaN{{O}_{3}}+C{{O}_{2}}\uparrow +{{H}_{2}}O \)
b) Sau phản ứng H2CO3sinh ra phân hủy ngay thành CO2và H2
\( \Rightarrow \) Acid HNO3 là acid mạnh và acid H2CO3 là acid yếu.
Trong các chất dưới đây, chất nào có tính acid yếu nhất?
A. H2SO4.
B. HClO4.
C. H3PO4.
D. H2SiO3.
Hướng dẫn giải:
Các nguyên tố Si, P, S, Cl có điện tích tăng dần và cùng thuộc chu kì 3 nên tính acid của hydroxide ứng với hóa trị cao nhất tăng dần.
\( \Rightarrow \) Acid H2SiO3 có tính acid yếu nhất.
Dãy gồm các chất có tính base tăng dần là
A. Al(OH)3, Mg(OH)2, NaOH.
B. NaOH, Mg(OH)2, Al(OH)3.
C. Mg(OH)2, Al(OH)3, NaOH.
D. Al(OH)3, NaOH, Mg(OH)2.
Hướng dẫn giải:
Đáp án A
Các nguyên tố Na, Mg, Al thuộc cùng chu kỳ, được xếp lần lượt theo chiều tăng của điện tích hạt nhân.
Lại có, trong một chu kì theo chiều tăng của điện tích hạt nhân tính base của oxide tương ứng giảm dần.
\( \Rightarrow \) Dãy gồm các chất có tính base tăng dần là Al(OH)3, Mg(OH)2, NaOH.
Những đại lượng và tính chất nào của nguyên tố hóa học cho dưới đây khôngbiến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử?
A. Tính kim loại và phi kim.
B. Tính acid – base của các hydroxide.
C. Khối lượng nguyên tử.
D. Cấu hình electron lớp ngoài cùng của nguyên tử.
Hướng dẫn giải:
Đáp án C
Khối lượng nguyên tử không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
So sánh được tính acid và base của các oxide và hydroxide dựa vào vị trí nguyên tố tạo nên chúng trong bảng tuần hoàn nguyên tố hóa học.
Hướng dẫn giải:
Để so sánh được tính acid và base của các oxide và hydroxide dựa vào vị trí nguyên tố tạo nên chúng trong bảng tuần hoàn nguyên tố hóa học cần ghi nhớ:
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
Các bài toán cùng chủ đề!
Các sách luyện thi do Trung tâm phát hành!
Trung Tâm Luyện Thi Đại Học được xây dựng trên WordPress

