Trung Tâm Luyện Thi Đại Học
Bài 12. Liên kết cộng hóa trị
Mở đầu – Trang 55
Nguyên tử hydrogen và chlorine dễ dàng kết hợp để tạo thành phần tử hydrogen chloride (HCl), liên kết trong trường hợp này có gì khác so với liên kết ion trong phân tử sodium chloride (NaCl)?
Hướng dẫn giải:
Liên kết trong phân tử hydrogen chloride là liên kết cộng hóa trị, giữa hai nguyên tử hydrogen và chlorine có một cặp electron dùng chung.
Liên kết trong phân tử sodium chloride là liên kết ion, được tạo thành nhờ lực hút tĩnh điện của các ion mang điện tích trái dấu.
I. Sự tạo thành liên kết cộng hóa trị – Trang 58
Lắp ráp mô hình một số phân tử
Chuẩn bị: Bộ lắp ráp mô hình các phân tử CH4, C2H4, C2H2, C2H5OH, CH3COOH.
Tiến hành:
– Chọn hình cầu có màu sắc khác nhau đại diện cho nguyên tử C, O, H.
– Lắp các hình cầu và que nối theo mẫu (Hình 12.8).

Quan sát mô hình và cho biết số liên kết đơn, liên kết đôi, liên kết ba trong mỗi phân tử.
Hướng dẫn giải:
– Học sinh tự lắp ráp mô hình các phân tử như hình 12.8.
– Phân tử methane có 4 liên kết đơn.
– Phân tử ethene có 4 liên kết đơn + 1 liên kết đôi.
– Phân tử ethyne có 2 liên kết đơn + 1 liên kết ba.
– Phân tử ethanol có 8 liên kết đơn.
– Phân tử ethanoic acid có 6 liên kết đơn + 1 liên kết đôi.
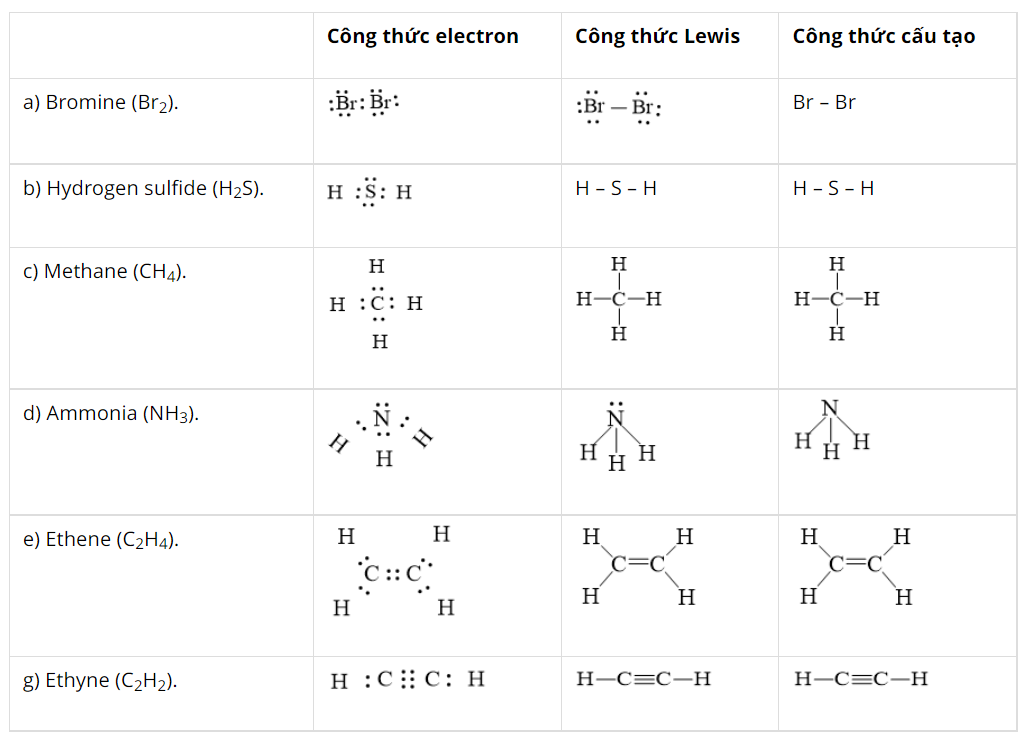
Viết công thức electron, công thức cấu tạo và công thức Lewis của các phân tử.
a) Bromine (Br2).
b) Hydrogen sulfide (H2S).
c) Methane (CH4).
d) Ammonia (NH3).
e) Ethene (C2H4).
g) Ethyne (C2H2).
Hướng dẫn giải:
II. Độ âm điện và liên kết hóa học – Trang 59
Dựa vào giá trị độ âm điện trong Bảng 6.2, dự đoán loại liên kết (liên kết cộng hoá trị phân cực, liên kết cộng hoá trị không phân cực, liên kết ion) trong các phân tử: MgCl2, AlCl3, HBr, O2, H2, NH3.
Hướng dẫn giải:
– Trong phân tử MgCl2, hiệu độ âm điện của Mg và Cl: 3,16 – 1,31 = 1,85.
\( \Rightarrow \) Liên kết giữa Mg và Cl là liên kết ion.
– Trong phân tử AlCl3, hiệu độ âm điện của Al và Cl: 3,16 – 1,61 = 1,55.
\( \Rightarrow \) Liên kết giữa Al và Cl là liên kết cộng hóa trị phân cực.
– Trong phân tử HBr, hiệu độ âm điện của Br và H: 2,96 – 2,2 = 0,76.
\( \Rightarrow \) Liên kết giữa Br và H là liên kết cộng hóa trị phân cực.
– Trong phân tử O2, hiệu độ âm điện: 3,44 – 3,44 = 0.
\( \Rightarrow \) Liên kết giữa O và O là liên kết cộng hóa trị không phân cực.
– Trong phân tử H2, hiệu độ âm điện: 2,2 – 2,2 = 0.
\( \Rightarrow \) Liên kết giữa H và H là liên kết cộng hóa trị không phân cực.
– Trong phân tử NH3, hiệu độ âm điện của N và H: 3,04 – 2,2 = 0,84.
\( \Rightarrow \) Liên kết giữa N và H là liên kết cộng hóa trị phân cực.
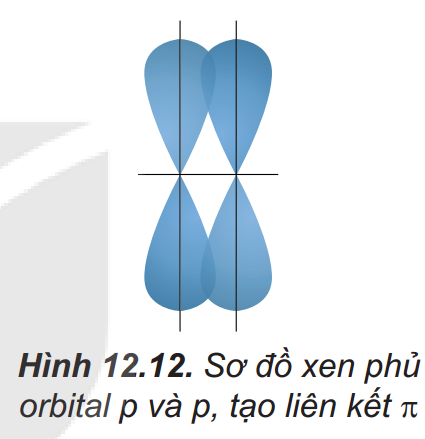
III. Mô tả liên kết cộng hóa trị bằng sự xen phủ orbital nguyên tử – Trang 61
Sự hình thành liên kết \( \sigma \) và liên kết \( \pi \) khác nhau như thế nào?
Hướng dẫn giải:
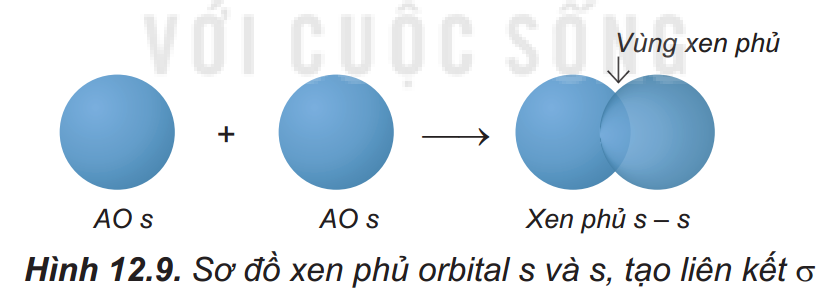
– Sự xen phủ trục, tạo ra liên kết \( \sigma \). Xen phủ trục là các orbital sẽ xen phủ với nhau theo trục liên kết. Có ba loại xen phủ trục:
+ Sự xen phủ s – s
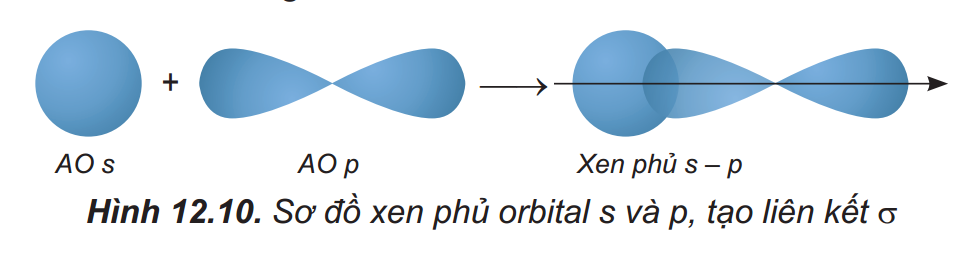
+ Sự xen phủ s – p
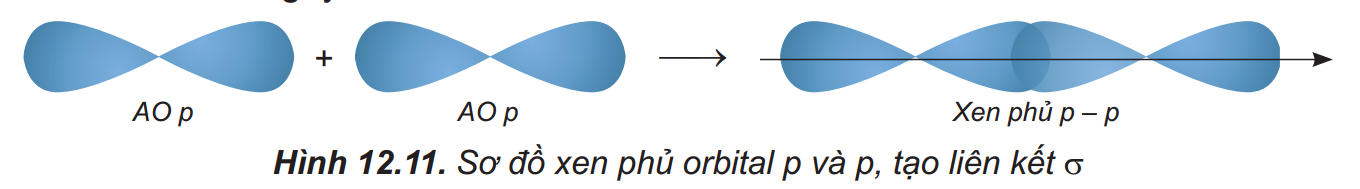
+ Sự xen phủ p – p
– Sự xen phủ bên tạo ra liên kết \( \pi \). Sự xen phủ bên là sự xen phủ, trong đó các orbital tham gia liên kết song song với nhau và vuông góc với đường nối tâm của hai nguyên tử liên kết.
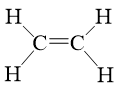
Số liên kết \( \sigma \) và \( \pi \) có trong phân tử C2H4 lần lượt là
4 và 0.
2 và 0.
1 và 1.
5 và 1.
Hướng dẫn giải:
Trong phân tử C2H4 có 5 liên kết \( \sigma \) và 1 liên kết \( \pi \).
IV. Năng lượng liên kết cộng hóa trị – Trang 62
Năng lượng liên kết là gì? Năng lượng liên kết của phân tử Cl2 là 243 kJ/mol cho biết điều gì?
Hướng dẫn giải:
– Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết hoá học trong phân tử ở thể khí thành các nguyên tử ở thể khí. Năng lượng liên kết đặc trưng cho độ bền của liên kết.
– Năng lượng liên kết của phân tử Cl2 là 243 kJ/mol cho biết: để phá vỡ 1 mol liên kết Cl – Cl thành các nguyên tử Cl (ở thể khí) cần năng lượng là 243 kJ.
Dựa vào giá trị năng lượng liên kết ở Bảng 12.2, hãy chọn phương án đúng khi so sánh độ bền liên kết giữa Cl2, Br2và I2.
A. I2> Br2> Cl2.
B. Br2> Cl2> I2.
C. Cl2> Br2> I2.
D. Cl2 > I2 > Br2.
Hướng dẫn giải:
Dựa vào Bảng 12.2, ta thấy, năng lượng liên kết Cl – Cl > năng lượng liên kết Br – Br > năng lượng liên kết I – I.
\( \Rightarrow \) Độ bền liên kết giảm từ Cl2 > Br2 > I2.
Phân biệt được liên kết ion, liên kết cộng hóa trị phân cực và liên kết cộng hóa trị không phân cực theo độ âm điện.
Hướng dẫn giải:
Dựa vào hiệu độ âm điện của các nguyên tử, dự đoán loại liên kết:
+ \( 0\le \left| {{\Delta }_{x}} \right|<0,4 \): liên kết cộng hóa trị không phân cực.
+ \( 0,4\le \left| {{\Delta }_{x}} \right|<1,7 \): liên kết cộng hóa trị phân cực.
+ \( \left| {{\Delta }_{x}} \right|\ge 1,7 \): liên kết ion.
Các bài toán cùng chủ đề!
Các sách luyện thi do Trung tâm phát hành!
Trung Tâm Luyện Thi Đại Học được xây dựng trên WordPress

