Trung Tâm Luyện Thi Đại Học
Bài 4. Ôn tập chương 1
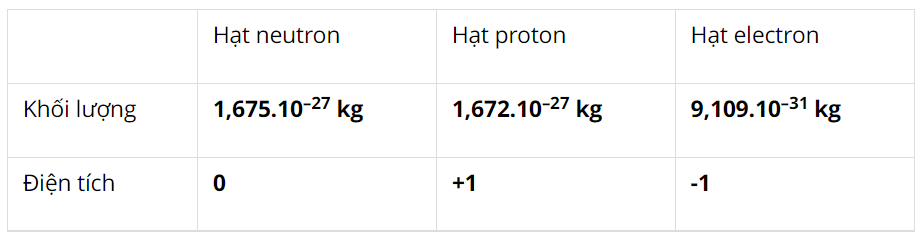
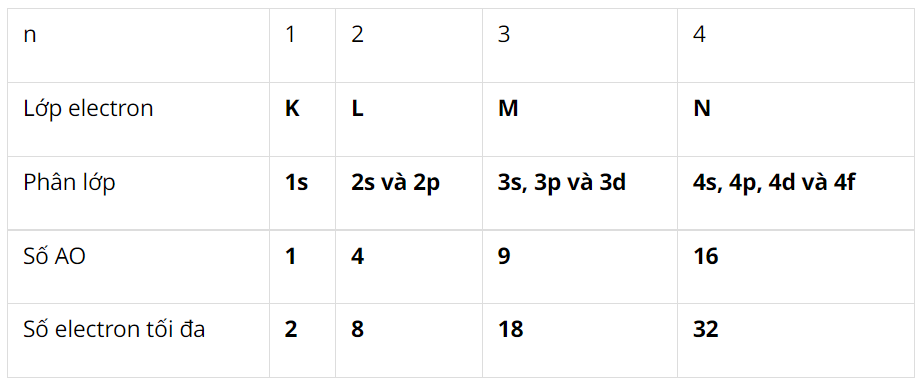
I. Hệ thống hóa kiến thức – Trang 26
Hoàn thành sơ đồ hệ thống hóa kiến thức trang 26
Hướng dẫn giải:
– Nguyên tử có kích thước: vô cùng nhỏ bé, khối lượng: me + mp + mn; Z = số proton = số electron.
– AO s có dạng hình cầu; AO p gồm AO px, AO py, AO pz; AO p có dạng hình số 8 nổi.
– Thứ tự năng lượng các phân lớp từ thấp đến cao: 1s 2s 2p 3s 3p 4s …
– Cấu hình electron:

+ Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao
+ Nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau.
+ Quy tắc Hund: Trong cùng một phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau.
– Nguyên tố hóa học:
+ Số khối (A) = Z + số neutron
+ Kí hiệu nguyên tử:
+ Đồng vị \( _{a}^{b}X \) và \( _{a}^{d}X \) \( \Rightarrow \overline{A}=\frac{b.{{x}_{1}}+d.{{x}_{2}}}{{{x}_{1}}+{{x}_{2}}} \) với x1 và x2 lần lượt là phần trăm số nguyên tử của 2 đồng vị.
II. Luyện tập – Trang 27
Câu 1. Số proton, neutron và electron của \(_{19}^{39}K\) lần lượt là:
A. 19, 20, 39.
B. 20, 19, 39.
C. 19, 20, 19.
D. 19, 19, 20.
Hướng dẫn giải:
Đáp án C
Dựa trên kí hiệu nguyên tử \(_{19}^{39}K\) xác định được:
Số electron = Số proton = Z = 19
Số neutron = A – Z = 39 – 19 = 20
Câu 2. Nguyên tử của nguyên tố nào sau đây có 3 electron thuộc lớp ngoài cùng?
A. \( _{11}^{23}Na \).
B. \( _{7}^{14}N \).
C. \( _{13}^{27}Al \).
D. \( _{6}^{12}C \).
Hướng dẫn giải:
Đáp án C
Ta có: Số electron = Z
– Cấu hình electron của Na (Z = 11) là 1s22s22p63s1 \( \Rightarrow \) Nguyên tử Na có 1 electron lớp ngoài cùng.
– Cấu hình electron của N (Z = 7) là 1s22s22p3 \( \Rightarrow \) Nguyên tử N có 5 electron lớp ngoài cùng.
– Cấu hình electron của Al (Z = 13) là 1s22s22p63s23p1 \( \Rightarrow \) Nguyên tử Al có 3 electron lớp ngoài cùng.
– Cấu hình electron của C (Z = 6) là 1s22s22p2 \( \Rightarrow \) Nguyên tử C có 4 electron lớp ngoài cùng.
Câu 3. Nguyên tử của nguyên tố potassium có 19 electron. Ở trạng thái cơ bản, potassium có số orbital chứa electron là
A. 8
B. 9.
C. 11.
D. 10.
Hướng dẫn giải:
Đáp án D
Cấu hình electron của potassium là 1s22s22p63s23p64s1 có thể được biểu diễn theo ô orbital như sau:
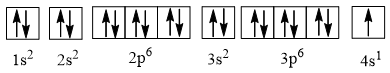
\( \Rightarrow \) Potassium có 10 orbital chứa electron.
Câu 4. Nguyên tử của nguyên tố sodium (Z = 11) có cấu hình electron là
A. 1s22s22p63s2.
B. 1s22s22p6.
C. 1s22s22p63s1.
D. 1s22s22p53s2.
Hướng dẫn giải:
Đáp án C
Số electron = Z = 11
\( \Rightarrow \) Cấu hình electron của nguyên tử là 1s22s22p63s1.
Câu 5. Tổng số hạt proton, neutron và electron trong nguyên tử X là 58. Số hạt mang điện nhiều hơn số hạt không mang điện là 18. X là
A. Cl.
B. Ca.
C. K.
D. S.
Hướng dẫn giải:
Đáp án C
Gọi số hạt proton, neutron và electron trong nguyên tử X lần lượt là p, n và e.
Theo bài ta có:
\( \left\{ \begin{align} & p+e+n=58 \\ & (p+e)-n=18 \\ & p=e \\ \end{align} \right. \) \( \Leftrightarrow \left\{ \begin{align} & 2p+n=58 \\ & 2p-n=18 \\ & p=e \\ \end{align} \right. \) \( \Leftrightarrow \left\{ \begin{align} & p=e=19 \\ & n=20 \\ \end{align} \right. \).
\( \Rightarrow \) Theo bảng tuần hoàn, nguyên tố thuộc ô 19 là K.
Câu 6. Nguyên tố chlorine có Z = 17. Hãy cho biết số lớp electron, số electron thuộc lớp ngoài cùng, số electron độc thân của nguyên tử chlorine.
Hướng dẫn giải:
Ta có: số electron = Z = 17
\( \Rightarrow \) Cấu hình electron của chlorine là 1s22s22p63s23p5.
\( \Rightarrow \) Nguyên tử chlorine có 3 lớp electron và 7 electron lớp ngoài cùng.
Cấu hình electron theo ô orbital là
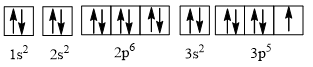
\( \Rightarrow \) Số electron độc thân bằng 1.
Câu 7. Nguyên tử khối trung bình của vanadium (V) là 50,94. Nguyên tố V có 2 đồng vị trong đó đồng vị \( _{23}^{50}V \) chiếm 0,25%. Tính số khối của đồng vị còn lại.
Hướng dẫn giải:
Giả sử đồng vị còn lại của V có dạng \( _{23}^{A}V \)và chiếm 100% – 0,25% = 99,75%.
\( \Rightarrow 50,94=\frac{50.0,25+A.99,75}{100}\Rightarrow A\approx 50,9424 \).
Câu 8. Cấu hình electron của:
– Nguyên tử X: 1s22s22p63s23p64s1;
– Nguyên tử Y: 1s22s22p63s23p4.
a) Mỗi nguyên tử X và Y chứa bao nhiêu electron?
b) Hãy cho biết số hiệu nguyên tử của X và Y.
c) Lớp electron nào trong nguyên tử X và Y có mức năng lượng cao nhất?
d) Mỗi nguyên tử X và Y có bao nhiêu lớp electron, bao nhiêu phân lớp electron?
e) X và Y là nguyên tố kim loại, phi kim hay khí hiếm?
Hướng dẫn giải:
a) Nguyên tử X chứa 19 electron, nguyên tử Y chứa 16 electron.
b) Số hiệu nguyên tử Z = số proton = số electron.
\( \Rightarrow \) Số hiệu nguyên tử của X và Y lần lượt là 19 và 16.
c) Các electron sắp xếp thành từng lớp và phân lớp theo năng lượng từ thấp đến cao.
\( \Rightarrow \) Các electron ở phân lớp ngoài cùng có mức năng lượng cao nhất.
\( \Rightarrow \) Lớp electron thứ 4 trong nguyên tử X có mức năng lượng cao nhất.
Lớp electron thứ 3 trong nguyên tử Y có mức năng lượng cao nhất.
d) Dựa vào cấu hình electron của X và Y, ta có:
– Nguyên tử X có 4 lớp electron và 6 phân lớp electron (1s, 2s, 2p, 3s, 3p, 4s).
– Nguyên tử Y có 3 lớp electron và 5 phân lớp electron (1s, 2s, 2p, 3s, 3p).
e) Nguyên tử X có 1 electron lớp ngoài cùng nên X là kim loại.
Nguyên tử Y có 6 electron lớp ngoài cùng nên Y là phi kim.
Câu 9.Nguyên tố X được dùng để chế tạo hợp kim nhẹ, bền, dùng trong nhiều lĩnh vực: hàng không, ô tô, xây dựng, hàng tiêu dùng, …. Nguyên tố Y ở dạng \( YO_{4}^{3-} \), đóng vai trò quan trọng trong các phân tử sinh học như DNA và RNA. Các tế bào sống sử dụng \( YO_{4}^{3-} \) để vận chuyển năng lượng. Nguyên tử của nguyên tố X có cấu hình electron kết thúc ở phân lớp 3p1. Nguyên tử của nguyên tố Y có cấu hình electron kết thúc ở phân lớp 3p3. Viết cấu hình electron nguyên tử của X và Y. Tính số electron trong các nguyên tử X và Y. Nguyên tố X và Y có tính kim loại hay phi kim?
Hướng dẫn giải:
– Nguyên tử của nguyên tố X có cấu hình electron kết thúc ở phân lớp 3p1.
\( \Rightarrow \) Cấu hình electron nguyên tử của X là 1s22s22p63s23p1.
\( \Rightarrow \) Lớp ngoài cùng có 3 electron.
\( \Rightarrow \) Nguyên tố X là kim loại.
– Nguyên tử của nguyên tố Y có cấu hình electron kết thúc ở phân lớp 3p3.
\( \Rightarrow \) Cấu hình electron nguyên tử của Y là 1s22s22p63s23p3.
\( \Rightarrow \) Lớp ngoài cùng có 5 electron.
\( \Rightarrow \) Nguyên tố Y là phi kim.
Câu 10. Nguyên tử của nguyên tố X có tổng số hạt cơ bản (proton, electron, neutron) là 49, trong đó số hạt không mang điện bằng 53,125% số hạt mang điện. Xác định điện tích hạt nhân, số proton, số electron, số neutron và số khối của X.
Hướng dẫn giải:
Gọi số hạt proton, electron, neutron lần lượt là p, e, n.
Ta có:
\( \left\{ \begin{align} & p+e+n=49 \\ & n=\frac{53,125}{100}(p+e) \\ & p=e \\ \end{align} \right. \) \( \Leftrightarrow \left\{ \begin{align} & p=e=16 \\ & n=17 \\ \end{align} \right. \).
\( \Rightarrow \) Số proton = số electron = 16 hạt, số neutron = 17 hạt.
\( \Rightarrow \) Điện tích hạt nhân là +16 và số khối A = 16 + 17 = 33.
Các bài toán cùng chủ đề!
Các sách luyện thi do Trung tâm phát hành!
Trung Tâm Luyện Thi Đại Học được xây dựng trên WordPress

