Trung Tâm Luyện Thi Đại Học
Bài 10. Quy tắc octet
Mở đầu – Trang 49
Khi các nguyên tử kết hợp với nhau tạo thành phân tử theo một tỉ lệ xác định, yếu tố nào quyết định tỉ lệ số nguyên tử của mỗi nguyên tố trong phân tử đó?
Hướng dẫn giải:
Yếu tố quyết định đến tỉ lệ số nguyên tử của mỗi nguyên tố trong phân tử đó là tỉ lệ số electron nhường, nhận hay góp chung của nguyên tử khi tham gia liên kết để hình thành phân tử.
I. Khái niệm liên kết hóa học – Trang 49
Khi nguyên tử fluorine nhận thêm 1 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố nào?
Hướng dẫn giải:
Cấu hình electron của nguyên tử fluorine là 1s22s22p5.
\( \Rightarrow \) Khi nguyên tử fluorine nhận thêm 1 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố Ne (1s22s22p6).
Để giảm năng lượng, các nguyên tử kết hợp lại thành phân tử theo xu hướng nào?
Hướng dẫn giải:
Để giảm năng lượng, các nguyên tử kết hợp lại thành phân tử theo xu hướng đạt tới cấu hình electron bền vững của khí hiếm.
II. Quy tắc octet – Trang 50
Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử F2, CCl4 và NF3.
Hướng dẫn giải:
– Hình thành liên kết trong phân tử F2
Khi hình thành liên kết hoá học trong phân tử F2, nguyên tử fluorine có 7 electron hoá trị, mỗi nguyên tử fluorine cần thêm 1 electron để đạt cấu hình electron bão hoà theo quy tắc octet nên mỗi nguyên tử fluorine góp chung 1 electron.
Phân tử F2 được biểu diễn như sau:
![]()
Xung quanh mỗi nguyên tử fluorine đều có 8 electron.
– Hình thành liên kết trong phân tử CCl4
Khi hình thành liên kết hoá học trong phân tử CCl4, nguyên tử chlorine có 7 electron hoá trị, mỗi nguyên tử chlorine cần thêm 1 electron để đạt cấu hình electron bão hoà, nguyên tử carbon có 4 electron hóa trị nên nguyên tử carbon sẽ góp chung với mỗi nguyên tử chlorine 1 electron.
Phân tử CCl4 được biểu diễn như sau:
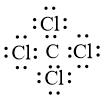
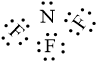
– Hình thành liên kết trong phân tử NF3
Khi hình thành liên kết hoá học trong phân tử NF3, nguyên tử fluorine có 7 electron hoá trị, mỗi nguyên tử fluorine cần thêm 1 electron để đạt cấu hình electron bão hoà, nguyên tử nitrogen có 5 electron hóa trị nên nguyên tử nitrogen sẽ góp chung với mỗi nguyên tử fluorine 1 electron.
Phân tử NF3 được biểu diễn như sau:
Phosphine là hợp chất hoá học giữa phosphorus với hydrogen, có công thức hóa học là PH3. Đây là chất khí không màu, có mùi tỏi, rất độc, không bền, tự cháy trong không khí ở nhiệt độ thường và tạo thành khối phát sáng bay lơ lửng. Phosphine sinh ra khi phân huỷ xác động, thực vật và thường xuất hiện trong thời tiết mưa phùn (hiện tượng “ma trơi).Vận dụng quy tắc octet để giải thích sự tạo thành liên kết hoá học trong phosphine.
Hướng dẫn giải:
Khi hình thành liên kết hoá học trong phân tử PH3, nguyên tử hydrogen có 1 electron hoá trị, mỗi nguyên tử hydrogen cần thêm 1 electron để đạt cấu hình electron bão hoà, nguyên tử phosphine có 5 electron hóa trị nên nguyên tử phosphine sẽ góp chung với mỗi nguyên hydrogen 1 electron.
Phân tử PH3 được biểu diễn như sau:
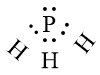
Vận dụng quy tắc octet để giải thích sự hình thành liên kết hóa học trong một số phân tử của các nguyên tử nguyên tố nhóm A.
Hướng dẫn giải:
Quy tắc octet: Khi hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.
Ví dụ:
– Phân tử O2
Khi hình thành liên kết hoá học trong phân tử O2, nguyên tử oxygen có 6 electron hoá trị, mỗi nguyên tử oxygen cần thêm 2 electron để đạt cấu hình electron bão hoà theo quy tắc octet nên mỗi nguyên tử oxygen góp chung 2 electron.
Phân tử O2 được biểu diễn như sau:
![]()
Các bài toán cùng chủ đề!
Các sách luyện thi do Trung tâm phát hành!
Trung Tâm Luyện Thi Đại Học được xây dựng trên WordPress

